Le Bureau des médicaments génériques de la FDA : un pilier de l’accès aux traitements abordables
Chaque jour, des millions d’Américains prennent des médicaments génériques. Ils coûtent jusqu’à 80 % moins cher que les médicaments de marque, mais ils sont tout aussi sûrs et efficaces. Ce n’est pas un hasard. Derrière cette disponibilité massive se trouve un petit mais puissant bureau de la FDA : le Bureau des médicaments génériques (OGD). Ce service, intégré au Centre d’évaluation et de recherche sur les médicaments (CDER), est chargé de veiller à ce que chaque comprimé, gélule ou injection générique qui arrive sur le marché réponde aux mêmes normes strictes que son équivalent de marque. Sans lui, les génériques seraient rares, lents à arriver, ou pire - de mauvaise qualité.
Comment l’OGD est devenu un bureau indépendant
Avant 2013, la révision des médicaments génériques était répartie entre plusieurs équipes, ce qui ralentissait tout. Les demandes s’accumulaient, les délais s’allongeaient, et les patients attendaient des traitements essentiels. En décembre 2013, la FDA a réorganisé son fonctionnement en créant l’OGD comme un « super bureau » directement rattaché au directeur du CDER. Cette décision n’était pas administrative : c’était une réponse à une crise de santé publique. Le nombre de génériques en attente de validation dépassait les 1 000, et certains patients souffraient de pénuries critiques.
Depuis cette restructuration, l’OGD dispose de son propre budget, de son équipe de gestion de projets, et d’une autonomie décisionnelle. Son objectif est clair : garantir que des génériques de haute qualité soient disponibles rapidement et à moindre coût. Cette réforme a permis de réduire les délais moyens d’approbation de plus de 30 % en cinq ans, selon les rapports internes de la FDA.
Structure interne : cinq bureaux spécialisés, une mission unique
L’OGD n’est pas un seul service, mais un écosystème organisé en cinq sous-bureaux, chacun avec un rôle précis.
- Bureau de la bioéquivalence (OB) : il détermine si un générique se comporte exactement comme le médicament de référence dans l’organisme. C’est ici que sont testées les formules, les taux d’absorption et les variations entre lots. Le bureau comprend aussi une équipe dédiée à la surveillance de la sécurité des médicaments.
- Bureau de la politique des médicaments génériques : il gère les questions juridiques complexes, notamment celles liées à la loi Hatch-Waxman de 1984. Cette loi permet aux génériques d’entrer sur le marché avant l’expiration des brevets, à condition de prouver leur équivalence. Ce bureau décide aussi des périodes d’exclusivité, qui protègent les premiers génériques à être approuvés.
- Bureau des opérations réglementaires (ORO) : c’est le moteur opérationnel. Il supervise les gestionnaires de projets réglementaires (RPM) qui suivent chaque demande d’approbation (ANDA) de son dépôt jusqu’à sa validation. Ils planifient, priorisent et répartissent les dossiers pour respecter les délais fixés par GDUFA.
- Bureau de la recherche et des normes (ORS) : il développe les nouvelles méthodes scientifiques pour évaluer les génériques. Par exemple, il utilise des modèles mathématiques pour prédire comment un médicament se comportera dans le corps sans avoir à faire des essais cliniques coûteux.
- Bureau de la sécurité et de l’évaluation clinique : il analyse les signalements d’effets indésirables liés aux génériques, travaille avec les hôpitaux et les pharmacies pour détecter les problèmes de qualité, et s’assure que les étiquettes de sécurité sont exactes.
Le Bureau immédiat (IO), en tête de cette structure, assure la direction stratégique, coordonne les équipes et sert d’interlocuteur principal pour le Congrès, les médias et les autorités étrangères.
Les règles qui guident tout : Hatch-Waxman et GDUFA
Le travail de l’OGD repose sur deux piliers juridiques. Le premier est la loi Hatch-Waxman de 1984. Elle a révolutionné le marché des médicaments en permettant aux fabricants de génériques de déposer une demande simplifiée (ANDA) sans avoir à répéter les essais cliniques coûteux. Ils doivent seulement prouver que leur produit est bioéquivalent au médicament de référence. Mais cette loi est complexe : elle gère les brevets, les exclusivités, les contestations légales. C’est pourquoi l’OGD a créé une équipe dédiée à la législation - la Division du soutien juridique et réglementaire - qui conseille l’ensemble du bureau sur ces questions.
Le second pilier est le Programme de redevances des utilisateurs de médicaments génériques (GDUFA). En 2012, la FDA a mis en place un système où les entreprises de génériques paient des frais pour financer leur propre évaluation. Ces redevances, qui ont été renouvelées en 2017 et en 2022, permettent à l’OGD d’embaucher plus de scientifiques, d’améliorer ses systèmes informatiques et de réduire les retards. Sans GDUFA, l’OGD n’aurait pas les ressources pour traiter les plus de 5 000 demandes d’ANDA reçues chaque année.
Responsabilités concrètes : ce que l’OGD fait vraiment chaque jour
La mission de l’OGD n’est pas théorique. Elle se traduit par des actions précises :
- Évaluer chaque demande d’approbation de générique pour s’assurer qu’elle contient le même principe actif, la même dose, la même forme (comprimé, sirop, injection) et qu’elle est absorbée de la même manière que le médicament de marque.
- Décider du moment où un générique peut être commercialisé, en tenant compte des brevets et des exclusivités légales.
- Identifier et accélérer les demandes pour les génériques de première génération ou pour des médicaments en pénurie - par exemple, des antibiotiques ou des traitements contre le cancer.
- Établir les normes scientifiques pour la bioéquivalence, en mettant à jour les méthodes de test pour les nouveaux types de médicaments (comme les produits biosimilaires ou les formulations complexes).
- Collaborer avec les autorités sanitaires internationales pour harmoniser les normes et éviter les retards dus à des exigences contradictoires à l’étranger.
- Assurer la cohérence entre les politiques de la FDA pour les médicaments de marque et les génériques, notamment en matière de sécurité (REMS) et d’étiquetage.
Chaque année, l’OGD approuve plus de 1 500 nouveaux génériques. En 2024, ces médicaments ont représenté 90 % de toutes les prescriptions aux États-Unis, et ont permis d’économiser plus de 400 milliards de dollars aux patients et aux systèmes de santé.
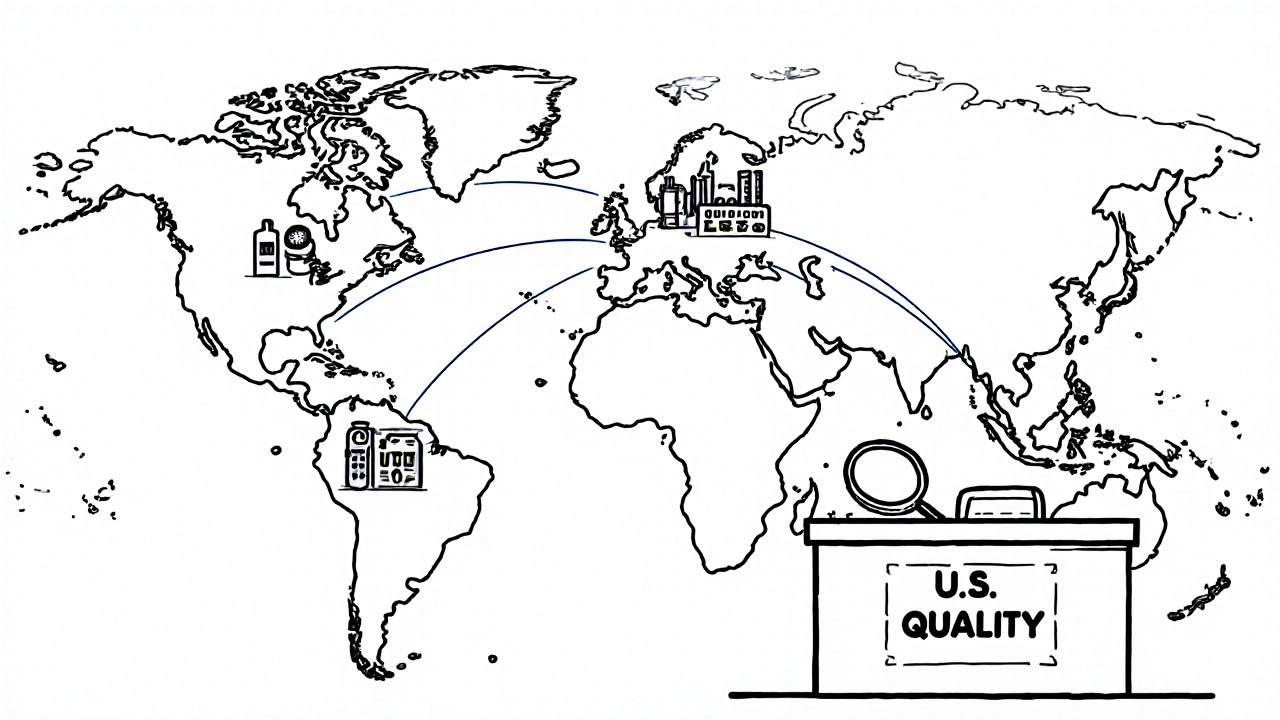
Le rôle mondial de l’OGD
L’OGD ne travaille pas seulement aux États-Unis. Son équipe des Affaires mondiales des génériques collabore avec l’OMS, l’EMA (Europe), la PMDA (Japon) et d’autres agences pour aligner les normes de qualité. Pourquoi ? Parce que de nombreux génériques vendus aux États-Unis sont fabriqués en Inde, en Chine ou en Corée. Si ces pays appliquent des normes différentes, les patients américains sont exposés à des risques. L’OGD effectue des inspections à l’étranger, partage ses méthodes d’évaluation et exige que les sites de production respectent les mêmes exigences que les usines américaines. C’est une forme de diplomatie scientifique : la qualité ne connaît pas de frontières.
Pourquoi cela vous concerne
Que vous preniez un générique pour votre hypertension, votre diabète ou votre dépression, vous dépendez du travail de l’OGD. Ce bureau est la garantie que votre médicament coûte moins cher sans être moins bon. Il empêche les produits défectueux d’entrer sur le marché. Il accélère l’arrivée de traitements essentiels quand ils sont en pénurie. Il protège les patients contre les abus de brevets qui maintiendraient les prix artificiellement hauts.
La prochaine fois que vous recevrez un générique à la pharmacie, sachez que des scientifiques, des juristes et des ingénieurs ont passé des mois à analyser chaque détail de ce produit. Ce n’est pas un simple copié-collé. C’est une science rigoureuse, encadrée par la loi, et financée par les entreprises elles-mêmes - avec un seul objectif : vous rendre la santé plus abordable, sans compromis sur la sécurité.
Quelle est la différence entre un médicament de marque et un générique ?
Un générique contient le même principe actif, à la même dose, dans la même forme (comprimé, injection, etc.) et est administré de la même manière qu’un médicament de marque. Il doit prouver qu’il est bioéquivalent - c’est-à-dire qu’il est absorbé par le corps de la même façon. La seule différence peut être dans les ingrédients inactifs (colorants, liants), qui n’affectent pas l’efficacité. Les génériques sont moins chers parce qu’ils n’ont pas à refaire les coûteux essais cliniques.
Combien de temps prend l’approbation d’un générique par la FDA ?
Selon les objectifs fixés par GDUFA, l’OGD doit rendre une décision sur une demande d’approbation (ANDA) dans les 10 à 12 mois après réception. Pour les premiers génériques ou les médicaments en pénurie, le délai peut être réduit à 6 mois. En 2024, 87 % des demandes ont été traitées dans les délais fixés, contre 65 % en 2012, avant la mise en place de GDUFA.
Les génériques sont-ils fabriqués dans les mêmes usines que les médicaments de marque ?
Oui, parfois. Environ 50 % des usines qui produisent des génériques produisent aussi des médicaments de marque. La FDA inspecte toutes les installations, qu’elles soient aux États-Unis ou à l’étranger, avec les mêmes normes. Les inspections sont inopinées et basées sur des risques. Si une usine ne respecte pas les normes, la FDA peut bloquer l’approbation ou interdire l’importation.
Comment l’OGD traite-t-il les signalements d’effets secondaires liés aux génériques ?
L’OGD collabore avec le système MedWatch de la FDA pour analyser tous les signalements d’effets indésirables. Si plusieurs cas similaires sont signalés, une enquête est déclenchée. L’équipe de sécurité examine la formulation, le fabricant, et compare avec les données du médicament de marque. Si un problème est confirmé, l’OGD peut exiger des modifications de l’étiquetage, une suspension temporaire, ou même un retrait du marché.
Qu’est-ce que la loi Hatch-Waxman et pourquoi est-elle importante ?
Adoptée en 1984, la loi Hatch-Waxman a créé le cadre légal pour les médicaments génériques aux États-Unis. Elle permet aux fabricants de génériques de déposer une demande simplifiée (ANDA) sans répéter les essais cliniques. En échange, elle protège les brevets des laboratoires de marque, en leur accordant une période d’exclusivité de 5 à 7 ans. Elle équilibre l’innovation et l’accès. Sans elle, les génériques n’existeraient pas dans leur forme actuelle.
Les génériques sont-ils aussi efficaces que les médicaments de marque pour les maladies chroniques ?
Oui. Des études menées par l’Institut de médecine et par l’Agence de recherche et de qualité en santé (AHRQ) ont confirmé que les génériques sont tout aussi efficaces que les médicaments de marque pour les maladies chroniques comme l’hypertension, le diabète ou les troubles thyroïdiens. Les variations de bioéquivalence autorisées (entre 80 % et 125 % d’absorption) sont trop faibles pour avoir un impact clinique sur la plupart des patients.



9 commentaires
Terry Bell
Je savais pas que derrière chaque générique, y avait une armée de scientifiques qui vérifient tout ça... C’est fou quand même, on croit que c’est juste une copie, mais non, c’est une science précise. Merci pour ce rappel, j’ai plus confiance en mes médicaments maintenant.
Christine Schuster
En France, on a tendance à mépriser les génériques, mais après avoir lu ça, je me demande si c’est pas juste de la méfiance culturelle. La qualité est là, les normes sont rigoureuses. Il faudrait que les médecins en parlent plus souvent comme ça.
Xavier Haniquaut
Le truc qui me choque, c’est que les usines en Inde ou en Chine sont inspectées comme les américaines. Je pensais que c’était du n’importe quoi, mais non, la FDA va vérifier sur place. C’est rassurant.
Olivier Rault
Je trouve ça super que les entreprises paient pour que leur propre médicament soit vérifié. Ça évite les retards et ça finance les contrôles. C’est un peu comme si tu payais pour que ton travail soit évalué… logique, non ?
Pascal Danner
Je suis un peu choqué… 400 milliards d’euros économisés… 90% des prescriptions… et pourtant, on entend encore des gens dire que les génériques, c’est « moins bon »… c’est vraiment triste… ça fait peur de voir à quel point la désinformation est ancrée…
Rochelle Savoie
Oh, encore un article qui fait l’éloge de la FDA… Comme si c’était une organisation divine. Et les fraudes ? Les inspections truquées ? Les usines chinoises qui trichent avec les normes ? Vous croyez vraiment que tout est parfait ?
marc f
En France, on a l’ANSM, mais ils n’ont pas ce niveau de transparence ni cette structure. L’OGD, c’est un modèle. On devrait l’imiter. La santé ne doit pas être un jeu de pouvoir entre labos et politiques.
Beatrice De Pascali
90% des prescriptions… et pourtant, les labos de marque continuent à faire des campagnes de marketing pour dénigrer les génériques. C’est du pur business. Et vous, vous croyez que la FDA est neutre ? Elle est financée par les entreprises qu’elle contrôle. C’est un cercle vicieux. 😒
Louise Marchildon
Je viens de demander à mon pharmacien de me donner le générique… il a hésité. J’ai lu ce post et je lui ai montré. Il a dit : "T’as raison, j’aurais dû te le proposer dès le début." Merci pour cette info, ça change les choses.